华山医院神经外科发现脑胶质瘤发生发展免疫新机制
来源:2016-04-26

历经8年,华山医院神经外科毛颖和姚瑜教授团队与其合作者在胶质瘤免疫研究方面取得了一项全新成果。该研究从多种胶质瘤生物样本出发,通过对免疫负性分子B7-H4的免疫作用及其转录调控机制的分析,证实了胶质瘤干细胞能诱导小胶质/巨噬细胞表达该蛋白,从而发生免疫逃逸并促进胶质瘤发生和发展,该成果为胶质瘤的免疫治疗提供了完全崭新的靶点和思路。2016年2月美国癌症研究协会的临床著名杂志Clinical Cancer Research刊登了该团队的这项首创研究论文B7-H4(B7x)-mediated cross-talk between glioma initiating cells and macrophages via the IL-6/JAK/STAT3 pathway lead to poor prognosis in glioma patients“胶质瘤干细胞-胶质瘤相关小胶质细胞通过IL-6/JAK/STAT3/ B7-H4(B7x)通路相互作用促进胶质瘤进展”。
脑疾病耗去的医疗费用即将达到全球GDP的10%,成为最大的医疗负担,也是我国目前面临的重大健康难题。胶质母细胞瘤(GBM)作为最常见的原发性中枢神经系统恶性肿瘤,发病率在肿瘤领域排名第九,但其在肿瘤死亡率中排名第四。目前尽管采取多种治疗模式相结合的综合体系,其中位总生存期(OS)仍然只有14.6个月,急需进行原创的机制研究以及相应治疗方法的开拓。华山医院神经外科胶质瘤团队在毛颖教授带领下,从临床实践出发,从免疫角度对这一顽症进行了长期的攻关研究。
免疫共刺激信号通路可以通过调节T细胞活性进而参与自身免疫病的形成、病毒感染以及癌症的形成,尤其是后者引起了研究者们广泛的研究热情;如果缺少共刺激信号分子的作用,T细胞将无法被激活,从而引起抗原特异性的免疫耐受。同时,免疫细胞表达某些共抑制分子,也会引起相似的作用,从而引起肿瘤的免疫逃逸。B7超家族既包括共刺激分子,也包含共抑制分子,当前易普利单抗靶向治疗CTLA-4已经被FDA批准上市,PD-1和PD-L1的靶向治疗抗体也已经进入III期临床试验阶段;B7-H4作为B7家族中除PD-L1外另一个最可能成为肿瘤诊断/预后的标志物以及治疗靶点,在肿瘤的临床相关性方面研究十分热门。大部分研究证实B7-H4表达水平与肿瘤等级、病理类型以及患者的预后相关。
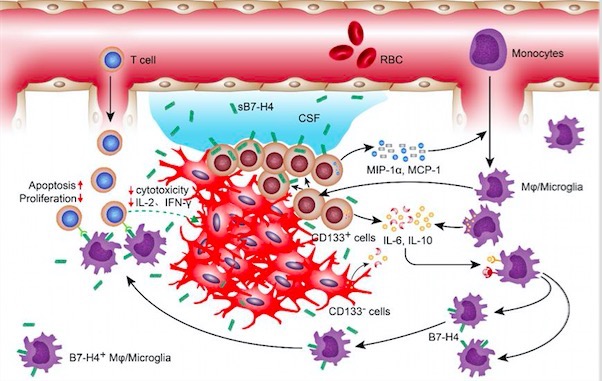
毛颖教授团队针对B7-H4在胶质瘤中的免疫抑制作用及相关机制进行了多年的深入研究,课题组通过TCGA胶质母细胞瘤数据库及华山医院胶质瘤组织芯片和脑脊液库等分析,证实B7-H4水平和胶质瘤恶性程度和预后显著相关。进一步通过胶质瘤组织切片免疫组化、免疫共聚焦结合胶质瘤病人MRS影像报告分析,发现B7-H4在胶质瘤边缘表达水平高于瘤巢,并主要以膜蛋白形式存在于肿瘤相关小胶质/巨噬细胞表面。通过ELISA检测CD133+细胞上清、荧光素酶质粒报告系统和CHIP试验,证实了STAT3可能与B7-H4上游启动子位点结合,IL-6—STAT3—B7-H4通路调控其在胶质瘤中表达;同时B7-H4高表达的小胶质细胞也会反向作用于CD133+胶质瘤干细胞,使其B7-H4表达上调。最后通过T细胞免疫功能实验及Kaplan-Meier生存曲线分析,证实了B7-H4通过抑制T细胞免疫功能从而促进肿瘤进展。该研究证实了在胶质瘤干细胞和小胶质细胞相互作用过程中,B7-H4可以通过抑制肿瘤免疫促进胶质瘤发生和发展,这对于进一步探索胶质瘤乃至恶性肿瘤免疫抑制机制提供了一个全新的思路和治疗靶点。
毛颖教授团队一直聚焦于脑肿瘤的精准治疗领域,开拓了关于胶质瘤起源、发病机制、免疫治疗靶点、个体化保护脑功能的手术、基于分子病理的放化疗等领域的临床研究,大大提高了胶质瘤疗效,延长了病人的生存时间。本研究受毛颖教授的国家杰出青年基金项目资助,日前该项杰青项目被国家基金委评为优秀等级。